BERYLLIUM
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18 |
|
H |
2 |
|
|
|
|
|
|
|
|
|
|
13 |
14 |
15 |
16 |
17 |
He |
|
Li |
Be |
|
|
|
|
|
|
|
|
|
|
B |
C |
N |
O |
F |
Ne |
|
Na |
Mg |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
Al |
Si |
P |
S |
Cl |
Ar |
|
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
|
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
|
Cs |
Ba |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
|
Fr |
Ra |
Ac |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
? |
? |
? |
|
? |
|
? |
|
? |
|
|
|
|
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
|
|
|
|
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
|
Be, atomnr. 4, molvekt 9,012182 g, elektronkonfigurasjon (He)+2s2,
smeltepunkt 1278± 5 °C, kokepunkt 2970 °C, tetthet 1,8477 g/cm3 (ved 20 °C). Beryllium har en god varmeledningsevne på 2,01 W/cm/K ved 25 °C, bare sølv, kobber, gull og aluminium har bedre. Varmeutvidelseskoeffisienten er middels, på 0,000012/K ved 25 °C, akkurat som jern og kobolt. Metallet er også en god elektrisk leder, med en motstandsevne på 4,0 mikrohm-cm ved 20 °C, bare sølv, kobber, gull, aluminium og kalsium har mindre. Elastisitetsmodulen er mer enn 30 % større enn for stål. Det er bare svakt diamagnetisk, med en magnetiserbarhet på -9,0 cgs-enheter. De viktigste spektrallinjene ligger i det ultrafiolette området, med 2349, 2650, 3130, 3131 og tre på 3321 Å som de sterkeste. Lydhastigheten i beryllium, 12500 m/s, er høyere enn i noe annet grunnstoff.Beryllium hører til gruppe 2 (også kalt hovedgruppe 2 eller II eller gruppe IIa og kjent som jordalkalimetallene) i
det periodiske systemet. Det har (1995) 8 kjente isotoper, hvorav en, beryllium 9, forekommer i naturlig tilstand. Av de radioaktive har Be 10 en halveringstid på 1,6 millioner år, Be 7 53,29 dager, mens de andre har noen få sekunder eller mindre. To av dem, Be 6 og Be 8, eksisterer bare en brøkdel av et mikrosekund før de henholdsvis spalter av to protoner eller deler seg i to alfapartikler.Beryllium mangler stabile partallsisotoper i motsetning til alle andre stabile partallsgrunnstoffer. Den vanligste isotopen av de letteste grunnstoffene er ellers de som består av et helt antall heliumkjerner. På grunn av den sterke kjernekraften, som virker tiltrekkende, er det vanligvis energi å vinne på å slå sammen lette atomkjerner. Men siden helium 4 er spesielt sterkt stabilisert av nukleonskalleffekten som likner den elektronskalleffekten som gjør edelgassene spesielt lite tilbøyelige til å avgi eller oppta elektroner, kreves det faktisk energi for å slå sammen to heliumkjerner til beryllium 8, derfor spaltes den igjen straks den er dannet. Når vi kommer til karbon har derimot den sterke kjernekraften blitt sterk nok til at tre heliumkjerner kan tjene energi på å slå seg sammen til karbon.
HISTORIE
Smaragder har vært kjent og høyt skattet siden oldtiden. Gaius Plinius Secundus (også kjent som Plinius den eldre) som levde fra år 23 til 79, skriver: "Man antar at beryll er av samme natur som smaragd, eller i det minste meget nærstående. De (smaragdene) produseres i India og er knapt å finne andre steder." Han nevner også beryllgruvene i åsene ved Rødehavet, som trolig var de eneste kjente beryllforekomstene i oldtiden. De ble gjenoppdaget av F. Caillaud i 1817 etter å ha ligget urørt siden Egypt ble erobret av romerne rundt vår tidsregnings begynnelse. Mye tyder på at de ikke ble tatt i bruk før i ptolemeertiden rundt år 300 før vår tidsregning. Smaragder sto også høyt i kurs hos aztekerne, de ble brukt i kongelige smykker og prydet også gudebildene.
På 1790-tallet fikk den prøyssiske kjemikeren Martin Heinrich Klaproth en smaragd i gave av fyrst Dmitrij Galitsin, en russisk adelsmann og mineralogientusiast, med beskjed om at den skulle analyseres. Han analyserte den og kom til at den inneholdt 68,25 % kiseljord (SiO2), 31,25 % leirjord (Al2O3) og 0,50 % rust. Beryll var allerede analysert av Torbern Bergman i Sverige, Franz Karl Achard i Preussen(?), J.J. Bindheim i Russland(?) og Nicolas-Louis Vauquelin i Frankrike og de var enige om at det var et kalsiumaluminiumsilikat. Men den franske mineralogen og presten René-Just Haüy fant under de omfattende krystallografiske undersøkelsene sine at beryll og smaragd var helt identiske geometrisk, og ba Vauquelin i 1798 om å gjøre en ny analyse.
Han fant at smaragden i likhet med rubin inneholdt litt krom, men at både smaragden og beryllen inneholdt ca. 14 % av en ukjent jordart (eller oksyd som vi helst kaller det) som både han og Klaproth hadde oversett fordi den liknet leirjorden (aluminiumoksydet). Men nå fant han at hydroksydet som falt ut når det ble tilsatt kaustisk pottaske (kaliumhydroksyd) til en syreløsning av beryllen, ikke lot seg løse igjen i et overskudd av alkaliet og at det også skilte seg fra leirjorden i at det ikke dannet noe alun, løste seg i ammoniumkarbonat og at saltene hadde en søt smak. Den 26. pluviose år 6 (eller 15. februar eller den tradisjonelle kalenderen) 1798 la han resultatene fram for Det franske akademiet og kalte den nye jordarten glucina, av gresk glykys 'søt', etter forslag fra redaksjonen i tidsskriftet Annales de Chimie et de Physique.
I en peruviansk smaragd fant Vauquelin 64,6 % kiseljord, 14 % leirjord, 13 % glucina, 2,56 % kalk, 3,5 % kromoksyd og 2 % væte eller andre flyktige substanser. På universitetet i Göttingen i kongeriket Hannover analyserte Johann Friedrich Gmelin en beryll fra Sibir og fant kiseljord, leirjord, glucina, ikke noe kalk, men en liten mengde rust. Klaproth, som allerede hadde oppdaget 3 grunnstoffer og hadde stor innflytelse i kjemiverdenen hevdet at siden saltene til den nyoppdagede ytterjorden også smakte søtt var det bedre å kalle den nye jordarten beryllia. Og slik ble det, unntatt i den fransktalende verden, hvor beryllium inntil ganske nylig gikk under betegnelsen glucinium, med kjemisk tegn Gl.
Den første som fremstilte metallisk beryllium var den bayerske kjemikeren Friedrich Wöhler, som på den tekniske byskolen i Berlin i Preussen i august 1828 reduserte berylliumklorid med kalium ved å pakke alternerende lag med klorid og kaliumskiver i en platinadigel og varmet opp blandingen med en alkohollampe. Reaksjonen var så intens at digelen ble hvitglødende. Etter avkjølingen vasket han ut digelen med vann og fant et gråsvart, metallisk pulver som ikke løste seg i vannet. Wöhler fastholdt beryllium som navn på grunnstoffet, mens den franske kjemikeren, farmakologen og legen Antoine-Alexandre-Brutus Bussy, som hadde åndsnærværelse nok til å foreta en liknende isolasjon samtidig, foretrakk glucinium.
René-Just Haüy, som ga støtet til oppdagelsen av beryllium, ble født i Saint-Just i Oise-provinsen i Frankrike den 28. februar 1743 og døde i Paris 3. juni 1822. Han var sønn av en fattig vever og fikk sin første utdannelse i klosteret i Saint-Just, hvor han likte å synge i koret og utmerket seg som en begavet og from elev. Abbeden sendte ham til Paris hvor han gjorde tjeneste som korgutt en periode før han ble opptatt på Navarra-kollegiet. Her gjorde han det bra og ble ansatt som lærer etter eksamen. I 1770 ble han viet til prest og utnevnt til professor i kollegiet til kardinal Lemoine. Her ble han venn med en annen professor som fikk ham interessert i botanikk. Før hadde det vært den klassiske litteraturen som hadde opptatt ham mest. Men en enda større aha-opplevelse fikk han i 1778 etter en forelesning om mineralogi av den kjente natursystematikeren Louis Daubenton i Jardin du Roi. Krystallene var en visjon av det perfekte i en langt fra feilfri verden, og studiet av krystallstrukturen tiltalte ham langt mer enn de kjemiske og geologiske egenskapene.
Det sies at da han undersøkte krystallsamlingen til Du Croisset var han så heldig at han mistet en praktfull kalkspatkrystall på gulvet. Den brakk i stykker, og han undersøkte bitene og ble forbløffet over formene de antok. Dette ble begynnelsen til en lang serie undersøkelser som førte til grunnleggelsen av den moderne krystallografien. Han undersøkte spalteretningene til alle krystaller han fikk lagt fingrene på og postulerte at krystaller av samme sammensetning alltid hadde den samme indre kjerne eller 'molécule intégrante', en enkel geometrisk grunnform, selv om de var forskjellige i det ytre, og at alle krystaller er sammensatt av slike grunnformer, som noen ganger kan bygge opp en krystall helt alene og noen ganger kan gjøre det sammen med et 'molécule soustractive', andre enkle former som fyller de tilsynelatende tomrommene. Han formulerte symmetriloven og beviste at krystallformene er helt bestemte og basert på faste lover.
I 1784 ble han valgt inn i vitenskapsakademiet, og etter 20 års tjeneste trakk han seg tilbake fra professoratet hos kardinal Lemoine for å vie seg helt til krystallografien. Under revolusjonen nektet han å avlegge troskapseden, ble satt i fangenskap i 1792 i Seminaire de Saint-Firmin og unnslapp med nød og neppe septembermassakrene. Papirene hans ble konfiskert og krystallsamlingen spredt for alle vinder. Men han fortsatte studiene som før og lot seg bare motvillig løskjøpe av kollegen og den tidligere eleven Geoffroy Saint-Hilaire. I 1794 ble han utnevnt til kurator i Cabinet des Mines, og samme år ble han professor i fysikk i Ecole Normale. Etter at Déodat Dolomieu (som dolomitten er oppkalt etter) døde i 1801 fikk han professoratet i mineralogi ved det naturhistoriske museet i Paris, hvor han ble en høyt elsket foreleser og fikk mange hengivne elever. Napoleon beundret ham og tildelte ham æreslegionen som en av de aller første. Etter restaurasjonen fikk han igjen problemer med de nye makthaverne. Han mistet professoratet og tilbrakte de siste årene sine i fattigdom. Men han lot det ikke gå inn på seg. Han hadde alltid levd et enkelt liv, hevet over jordiske problemer, og brukte disse siste årene til å fullføre sitt hovedverk, Traité de cristallographie, som kom ut to dager før han døde.
Ordet beryllium stammer altså fra tysk Beryll, som er lånt gjennom latin beryllus, berillus og gresk béryllos fra middelindisk veeruliya-, av sanskrit vaiduurya 'tigerøye, en kvartsvariant', som stammer fra bynavnet Viidura, byen er i sin tur oppkalt etter den mytologiske skikkelsen av samme navn, som bl.a. opptrer i eposet Mahabharata. Navnet har trolig sammenheng med indoeuropeisk u(e)id- 'se', som gjennom utvidelsen uoid-a- 'vite', germansk wait og norrønt vita ble til vite i norsk og utvidet til viten og vitende.
Germansk wait ble i oldhøytysk til wizzan og i eldre nyhøytysk til wissen, utvidet der til bewist, som er lånt til dansk og norsk som bevisst. I middelnedertysk ble wait til weten og utvidet til witlik, wet(e)lik, som er lånt til dansk og norsk som vitterlig.
Wait ble i germansk utvidet til witan- 'person som har sett eller vet', som gjennom urnordisk witania- og norrønt vitne ble til norsk vitne.
Wait fikk i germansk en utvidelse witeen 'straffe', substantivert til wiitia- 'straff', som i norrønt ble til víti, og av kristne misjonærer ble brukt i sammensetningen helvíti, som i norsk er blitt til helvete. I middelnedertysk fikk wiitia- en utvidelse vorwiisen, som er lånt til norsk som forvise.
En utvidelse av indoeuropeisk u(e)id- er ueid-s-o- 'vis', som gjennom germansk wiisa- og norrønt víss ble til norsk vis, med utvidelsen visdom, nesevis. En kausalform av wiisa- er wiisian, wiisoon 'gjøre klok', som i norrønt ble vísa 'vise, påpeke' og norsk vise, med utvidelsen viser. Wiisa- ble i middelnedertysk utvidet til bewiisen 'peke, forevise, påvise', som er lånt til norsk som bevise, og i tysk til Beweis, som er lånt til norsk som bevis.
En annen utvidelse av u(e)id- er ueid-to-, ueid-taa- 'utseende, beskaffenhet', som gjennom germansk wiisa-, wiisoo(n) 'måte, skikk', og norrønt vís ble til norsk vis og utvidelser som levevis, massevis, heldigvis, rimeligvis o.s.v. En norrøn utvidelse vísa 'strofe, dikt' ble til norsk vise.
En fortidsform av u(e)id- er uid-to- 'sett', som i germansk ble wissa- 'sikker', norrønt víss og norsk viss, med utvidelsene visshet, visst, visstnok. Germansk wissa- ble i middelnedertysk utvidet til vorwissen, som ble lånt til norsk som forvisse.
Fra u(e)id- kommer også latin videre, som er lånt til norsk i mange fremmedord som f.eks. revidere, visjon, video, avis, oftest gjennom fransk.
En avledning til latin berillus er det italienske verbet brillare 'stråle, glimre', som ble lånt til fransk som briller og der fikk en partisippform brillant. Begge er lånt til norsk som h.h.v. briljere og briljant, brilliant. Latin berillus var i Italiensk på 1300-tallet blitt til barillo 'safir', og da man begynte å lage brilleglass av safir, kalte man dem barelle, som ble lånt til middelhøytysk som berille, barille, som ble til Brille i tysk og derfra er lånt til norsk som brille.
GEOLOGI
Beryllium utgjør 0,00028 % av, og er det 48. mest utbredte grunnstoffet i den faste, øvre jordskorpen. I sjøvann er det 0,00000000056 % beryllium, og grunnstoffet ligger der på en 56.-plass. Også i universet som helhet er det lite beryllium, det utgjør etter vanlige estimater 0,000000010 % av all masse eller 0,00000061 av alt som ikke er hydrogen og helium, og ligger med dette helt nede på en 81.-plass.
Dette er uvanlig lite for et lett grunnstoff, og sammen med naboene litium og bor ligger beryllium nede i en 'dump' mellom helium og karbon som de grunnstoffdannende prosessene i universet nærmest 'hopper over'. Det meste av de aller letteste grunnstoffene, hydrogen og helium, ble dannet ved universets 'skapelse' i "Big Bang", sammen med en liten mengde litium. Men forøvrig er den viktigste grunnstoffdannende prosessen i denne delen av det periodiske systemet fusjon av heliumkjerner, som skjer i den siste fasen av livssyklusen til en stjerne. Derfor er isotoper som består av et helt antall He 4-kjerner langt vanligere enn andre i denne delen av det periodiske systemet, f.eks. C 12, O 16, Ne 20, Mg 24 o.s.v. Som nevnt over går ikke dette for beryllium.
Andre kjerner dannes ved mer energirike prosesser, som novaer og stjerneeksplosjoner, hvor tyngre kjerner støter sammen med stor kraft og bruddstykker rives løs i støtet. Det aller meste av disse bruddstykkene er enkelte nøytroner som lett opptas i andre kjerner slik at det f.eks. dannes C 13 utfra C 12 eller C 14 utfra C 13, som siden går over til N 14 ved naturlig radioaktivitet. Slike nøytronopptaksprosesser er viktigst for de tunge grunnstoffene. Men verken Li, Be eller B kan dannes av helium ved nøytronopptak på grunn av nukleonskalleffekten. Ingen av de tyngre grunnstoffene kan heller lages ved enkeltvis nøytronopptak i litium, på grunn av berylliumisotopen 8, som går i stykker straks den dannes.
Størstedelen av isotopene av disse 3 grunnstoffene er laget av bruddstykker av tyngre kjerner som har støtt sammen i voldsomme kollisjoner, såkalte spallasjonsprosesser, som naturlig nok skjer sjeldnere enn de mindre energikrevende prosessene. En kjerne av Be 9 kan f.eks. godt være resultatet av en front-mot-front-kollisjon mellom en jern- og en wolframkjerne, men det er nok atskillig mer vanlig at de er dannet etter en kraftig kollisjon mellom en C 12-kjerne og en heliumkjerne eller liknende. Som et biprodukt av den alminnelige energiproduksjonen i stjernene kan beryllium 9 dannes ved kollisjon mellom lettere kjerner, f.eks. tunge hydrogenisotoper og litium 7, og dette er en type reaksjon som også kan ha en vesentlig betydning.
Fordi det krever mer energi for hvert nukleon som skal slås ut av karbonkjernen er det mer bor enn beryllium i universet og mer beryllium enn litium. Beryllium mangler også partallsisotopen 8, og er det eneste grunnstoffet med uodde atomnummer som ikke har stabile uodde isotoper. Dette kommer av skalleffekten med He 4. Når to slike heliumkjerner slås sammen blir de til Be 8, men på grunn av skalleffekten krever denne isotopen så mye mer bindingsenergi for å holde sammen enn de to He 4-kjernene at den nesten umiddelbart spaltes til to He 4-kjerner igjen. Derfor mangler beryllium det store tilskuddet av isotoper som består av et helt antall heliumkjerner som de andre lette partallsgrunnstoffene har.
I jordskorpen drar disse tre lette grunnstoffene fordel av at de er lette og dermed konsentrerer seg i overflaten. Derfor er det atskillig større konsentrasjoner av dem her oppe enn i universet eller Jorda som helhet. Her oppe forbigås også beryllium av det enda lettere litium, også fordi litium som de andre alkalimetallene har en spesielt god affinitet til kvarts, feltspat og de andre bergartsdannende mineralene som er vanlige i den kontinentale jordskorpen.
Beryllium finnes i spormengder i jord og stein overalt i verden og
krystalliserer seg helst ut i egne mineraler på pegmatittganger, spredt vidt omkring i alle verdensdeler. Beryllium er (1977) en hovedbestanddel av 53 forskjellige mineraler, hvorav 33 silikater, 11 fosfater, 3 borater, 2 aluminater, 1 arsenat, 1 hydroksyd, 1 oksyd og 1 antimonat. Av de grunnstoffene som beryllium forekommer sammen med i mineraler, er oksygen vanligst med 53 mineraler (d.v.s. samtlige), deretter følger silisium med 33, hydrogen med 28, kalsium med 19, aluminium med 17, fosfor med 11, natrium med 10, fluor med 9, mangan med 6, jern med 5, magnesium med 4, litium, bor og svovel med 3, kalium, arsen, tinn, cesium og barium med 2 og klor, scandium, titan, krom, sink, yttrium, antimon, lantan, cerium og bly med 1 hver. Alt i alt en ganske gjennomsnittlig fordeling, men vi kan merke oss en viss forkjærlighet for kalsium og fluor sammenliknet med andre beslektede grunnstoffer. Interessant er også fraværet av karbonater, og svovelmineralene er ikke sulfater, de er kombinerte sulfid-silikater. Ellers hører beryllium avgjort til de oksygenkjære grunnstoffene (litofile) og holder seg unna de svovelkjære (chalkofile) som nikkel, sølv, kadmium og liknende. Det er en interessant tendens til at beryllium går inn på silisium-posisjonene i enkelte silikatmineraler.Beryll, Be3Al2Si6O18, er det klart viktigste berylliummineralet og det dominerende malmmineralet for beryllium. Det krystalliserer heksagonalt, i prismatiske sekskantede krystaller eller uregelmessige masser, oftest i granittpegmatitter, hvor krystallene kan bli 2-3 meter lange. Verdensrekorden er 5 meter med 70 cm diameter og 4,5 tonns vekt fra Iveland i Aust-Agder. Fargen er vanligvis lysegrønn til grønnblå, noen ganger gul eller hvit. Hardhet 8, tetthet 2,65-2,85 g/cm3, smeltepunkt 1410 °C, hvit strek, glassglans, en meget dårlig spalteflate på tvers av symmetriaksen. Kan inneholde noe Li i Al-posisjonene og Al i Be-posisjonene og Na-, K- og/eller Cs-ioner midt i ringene for ladningsnøytraliteten. På Hurumlandet finnes mørk blå beryll, i Tørdal i Telemark grønn, gul og blekrød i store krystaller. Akvamarin er en smykkesteinsvariant av beryll med sjøgrønn til grønnblå farge. Smaragd er en annen mørk grønn. Smaragder finnes i hulrom og sprekker i forskjellige bergarter og har vært funnet i Minnesund i sørenden av Mjøsa. Andre smykkesteinsvarianter er den gule heliodor og den rosa morganitt. Bazzitt er en scandiumholdig variant. En cesiumrik variant kalles vorobjevitt.
Krysoberyll, BeAl2O4, er et rombisk mineral med høy hardhet og en vakker gjennomsiktig grønnfarge. Mineralet brytes som berylliummalm. Rene varianter av smykkesteinskvalitet kalles alexandritt. Funnet i Norge ved Nateland i Iveland og ved Lindstøl i Søndeled.
Fenakitt, Be2SiO4, er et trigonalt, fargeløst mineral med hardhet 8 og tetthet 2,9 g/cm3 som er funnet i enestående store krystaller i pegmatitt ved Kragerø. Mineralet brytes noen steder som berylliummalm.
Bertranditt, Be4Si2O7(OH)2, rombisk mineral som er den nest viktigste berylliummalmen, et omvandlingsprodukt av beryll som i Norge er funnet i Iveland i Setesdalen.
Helvin, Mn4Be3(SiO4)3S, et gult, grønt eller rødligbrunt kubisk mineral som finnes i pegmatittganger og på kontaktforekomster, f.eks. i Oslofeltet. Genthelvin er en variant med sink og danalitt en variant med jern i stedet for mangan. I naturen forekommer vanligvis blandinger av de tre fasene.
Gadolinitt, Be2FeY2Si2O10, er et monoklint, svart mineral som er et av de mer utbredte svarte mineralene på granittpegmatitt i Norge. Rike forekomster i Iveland og på Hidra, hvor det er funnet krystaller på mange kg. Det er mer gadolinitt i Norge enn noe annet sted i verden. Utenfor Skandinavia regnes det som et nokså sjeldent mineral.
Eudidymitt, NaBeSi3O7(OH), er et monoklint mineral som forekommer i vakre perlemorglinsende fargeløse tvillingkrystaller på øyene i Langesundfjorden og ble først oppdaget der.
Melinofan, melifanitt, (Na,Ca)2Be(Si,Al)2(O,OH,F)7, et tetragonalt mineral som ble oppdaget i pegmatitt fra Langesundsfjorden i 1852.
Hambergitt, Be2(OH)BO3, et fargeløst til hvitt rombisk mineral som finnes ved Langesundsfjorden hvor det ble oppdaget av den norske geologen Waldemar C. Brøgger.
Verdensproduksjonen av beryllium er 300-350 tonn årlig. De største berylliumprodusentene er USA, Kina, Russland og Kazakstan. Brasil, Sørafrika, Argentina og India har også betydelige ressurser.
KJEMI
Beryllium er et sølvhvitt, glinsende, hardt og sprøtt metall med en heksagonal krystallform. Det er langt fra så reaktivt som de andre jordalkalimetallene og angripes verken av kaldt eller varmt vann og holder seg også godt i luft fordi det dekkes av en tynn og gjennomsiktig, beskyttende oksydfilm. Først ved over 600 °C går oksydasjonen videre. Det løser seg lett i fortynnet saltsyre og svovelsyre.
Beryllium har samme heksagonale tettpakkede struktur som magnesium, men til tross for at magnesiumatomene er mye tyngre er faktisk metallet lettere enn beryllium. Dette skyldes at berylliumatomene er mye mindre, det er bare 4 elektroner rundt dem mot 12 for magnesium, og metallradiene er henholdsvis 1,12 og 1,60 Å, slik at beryllium blir pakket tettere.
Beryllium er toverdig i alle sine forbindelser. Enverdige berylliumioner er observert i saltsmelter under elektrolyse, men enverdige berylliumforbindelser er aldri isolert. Beryllium likner på mange måter aluminium eller sink, og skiller seg ut fra de andre jordalkalimetallene. Beryllium danner (i motsetning til hva Vauquelin mente å observere) som aluminium og sink amfotert oksyd og hydroksyd, i motsetning til de andre jordalkalimetallene, som er helt basiske. Løselighetsforholdene skiller seg også ut, f.eks. er acetatet uløselig i vann, mens de andre jordalkalimetallene danner løselige acetater. Derimot er berylliumfluorid lettløselig mens de andre fluoridene er tungtløselige, og det samme gjelder oksalatene. Berylliumsaltene er generelt fargeløse på grunn av edelgasskonfigurasjonen til ionet. De smaker søtt, men det er best å ikke prøve, for de er svært giftige.
Fordi ladningen er veldig konsentrert på de små berylliumionene (radius 0,35 Å), deformerer (polariserer) de anionene de forbinder seg med mye, og berylliumforbindelser er derfor temmelig rent kovalente, i motsetning til forbindelsene til de andre jordalkalimetallene. De danner ofte molekylkrystaller som gjerne er flyktige og smelter lett, smeltede berylliumsalter har vanligvis meget dårlig elektrisk ledningsevne, og beryllium har mye større tendens til kompleksdannelse enn de andre jordalkalimetallene.
For å danne kovalente forbindelser må elektronparet i 2s-orbitalene skilles fra hverandre. I enkeltmolekyler hvor beryllium er bundet til to andre atomer skjer dette ved hjelp av sp-hybridorbitaler, slik at molekylet blir lineært. Men beryllium vil gjerne oppnå en 4-koordinasjon, og disse forbindelsene har en tendens til å polymeriseres i flytende eller fast fase. Slike polymerer er gjerne litt forlenget i lengderetningen i forhold til den ideelle tetraederkonfigrasjonen.
I vannløsning dannes det aldri frie berylliumioner, men et hydratkompleks, [Be(H2O)4]2+, forekommer i sterkt sur løsning. Løsninger av berylliumsalter er sure på grunn av dissosiasjonen [Be(H2O)4]2+ <> [Be(H2O)3(OH)]+ + H+. I andre løsningsmidler kan det dannes tilsvarende komplekser med løsningsmidlet, f.eks. med ammoniakk, [Be(NH3)4]2+, og dimetylformamid, [Be(HCON(CH3)2)4]2+.
Berylliumhydrid, BeH2, kan lages ved oppvarming av tert-butylberyllium, Be(C(CH3)3)2, til over 100 °C. Det er vanskelig å få rent. Trolig har det en polymerstruktur tilsvarende boranene eller berylliumhalogenidene. Det er mer kovalent enn saltaktig i sammensetningen i motsetning til de senere jordalkalimetallenes hydrider.
Berylliumkarbid, BeC2, egentlig et acetylenid, lages ved å varme metallet opp til 450 °C i en strøm av etylengass. Beryllium danner også et gult karbid Be2C som spalter av metan i vann og trolig inneholder C4--ionet. Det er stabilt ved oppvarming til over 2100 °C.
Beryllium danner mange organometalliske forbindelser. Rene berylliumalkylforbindelser kan best lages ved å oppvarme beryllium med kvikksølvalkylforbindelser, f.eks. Hg(C2H5)2 + Be = Be(C2H5)2 + Hg. Disse forbindelsene er sterkt reaktive væsker eller faste stoffer som spontanantenner i luft og hydrolyserer voldsomt i vann. Dimetylberyllium er en polymer, men tendensen til polymerisering synker med størrelsen av alkylgruppene. Dietyl- og diisopropylberyllium er dimerer, mens di-tert-butylberyllium er en monomer. Likheten mellom de alkylberylliumforbindelsene og hydridene er betydelig. Noen av dem spalter av alkener ved oppvarming slik at det dannes partielle hydrider, f.eks. gir isopropylberyllium en fargeløs, ikkeflyktig polymer, [(CH3)2HCBeH]n. Tert-butylberyllium gir derimot rent hydrid ved oppvarming, som nevnt.
Aryler lages ved reaksjon mellom en litiumaryl i et hydrokarbon og berylliumklorid i dietyleter hvor litiumklorid er uløselig, f.eks. 2 LiC6H5 + BeCl2 = 2 LiCl + Be(C6H5)2. Tolylberyllium opptrer som dimere molekyler.
Berylliumalkylforbindelser gir flotte fargede komplekser med bipyridin, (C5H4N)2. Fargene til slike komplekser med beryllium, sink, kadmium, aluminium og gallium med aromatiske aminer kommer trolig av elektronoverføring fra metall-karbonbindingen til den laveste uopptatte orbitalen i aminet.
Syklopentadienylforbindelsene med beryllium er spesielle fordi berylliumionet er så lite. Monopentadienylforbindelser, f.eks. C5H5BeCH3, er symmetriske, men i dipentadienylberyllium er den ene pentadienylgruppen symmetrisk og den andre skjevt, kanskje ionisk bundet. Undersøkelser tyder på at krystallstrukturen er nokså uordnet. Forbindelsen er svært ustabil i luft.
Ved oppvarming til 900-1000 °C reagerer beryllium med ammoniakk eller nitrogen til fargeløse krystaller av berylliumnitrid, Be3N2, som har et så høyt smeltepunkt som 2200 °C, men hydrolyseres lett i vann.
Alkylaminer av beryllium, f.eks. Be(N(CH3)2)2, danner ofte molekyler med 3 formelenheter (trimerer) hvor beryllium er koordinert til 4 nitrogenatomer i midten og 3 i de to ytterste. Lineære monomerer med bare en formelenhet dannes hvis aminogruppene er store, f.eks. bis-trimetylsilylaminet, Be(N(Si(CH3)3)2)2.
Når berylliumklorid behandles med litiumsaltet av 2,2'-bipyridin dannes det et grønt paramagnetisk kompleks.
I motsetning til de andre jordalkalimetallene har ikke beryllium koordinasjonstall 6 mot oksygen, men 4, fordi berylliumionet er så lite. Berylliumsalter krystalliserer ofte fra en vannløsning med 4 molekyler krystallvann som er kovalent bundet til ionet.
Berylliumoksyd, BeO, fås ved å oksydere beryllium ved over 600 °C eller oppvarme berylliumhydroksyd til 440 °C. Det er en ikkemolekylær forbindelse med et så høyt smeltepunkt som 2530 °C. Den har flere forskjellige krystallmodifikasjoner. Høytemperaturformen som dannes over 800 °C har en struktur av wurtzittypen som likner diamant og er spesielt syrefast.
Berylliumsulfid, BeS, er uløselig i vann, som sinksulfid, det dekomponerer ikke som sulfidene av de andre jordalkalimetallene og aluminium.
Berylliumchalkogenider som berylliumselenid, BeSe, og berylliumtellurid, BeTe, har interessante halvlederegenskaper og kan bli aktuelle for bruk i lysdioder og lasere.
Berylliumhydroksyd, Be(OH)2, felles som et hvitt, geléaktig bunnfall når løsninger av berylliumsalter tilsettes ammoniakk, men løses som beryllation, Be(OH)42-, ved tilsetning av mer base. Ved pH 5,5 i perkloratløsning dominerer det sykliske ionet [Be3(OH)3]3+.
Tilsetning av løselige karbonater til løsninger av berylliumsalter gir bare et basisk karbonat, BeCO3× Be(OH)2. Det er uløselig i kaldt vann, men dekomponerer i varmt.
Det er kjent vanlige karboksylater av beryllium, f.eks. acetat, (CH3COO)2Be, men noen spesielle oksykarboksylater fås ved å koke hydroksydet med organiske syrer. De har en underlig sammensetning med fire berylliumatomer i et tetraeder, et oksygenatom i midten av tetraedret og en syrerest langs hver av de 6 kantene av tetraedret med begge oksygenatomene i karboksylgruppen bundet til hvert sitt av berylliumatomene i tetraederhjørnene, f.eks. berylliumacetat, (CH3COO)6Be4O. De er vanligvis hvite, krystallinske forbindelser som løses i organiske løsningsmidler, også hydrokarboner, men ikke i vann og lettere alkoholer. I løsning foreligger de som monomere molekyler. De tåler vann, men hydrolyseres av fortynnede syrer. Også sink og zirkonyl (ZrO2+) danner benzoater med slik struktur, men sinkbenzoatet hydrolyseres lett av vann.
Alkoksyder av beryllium er vanligvis kondensert til di- eller trimerer eller lange polymerkjeder hvor berylliumatomene har en tetraedrisk koordinasjon til oksygenatomene. Berylliummetoksyd er en langkjedet polymer som er uløselig i hydrokarboner. Fenoksyder og andre forbindelser med plasskrevende grupper danner derimot gjerne lineære molekyler.
Krystaller av et berylliumnitrat-dinitrogentetroksydkompleks, Be(NO3)2× 2N2O4, fås hvis berylliumklorid løses i en etylacetatløsning av dinitrogentetroksyd. Ved oppvarming til 50 °C unnslipper nitrogenoksydet slik at det dannes rent, krystallinsk berylliumnitrat, Be(NO3)2, men ved videre oppvarming avspaltes mer N2O4 og det dannes et flyktig, molekylært oksynitrat, Be4O(NO3)6, med en struktur som likner den til oksyacetatet. Men dette nitratet er uløselig i upolare løsningsmidler.
Berylliumsulfat, BeSO4, kan fås ved å løse berylliumoksyd i svovelsyre. Det er mulig å lage vannfritt sulfat ved å varme opp tetrahydratet som fås fra løsningen, men det krever langt høyere temperatur enn hydratsulfatene av de andre jordalkalimetallene. Tetrahydratet er meget lettløselig i vann. Det vannfrie sulfatet er uløselig i kaldt vann, men i kokende vann tar det opp de fire vannmolekylene igjen og blir til det lettløselige tetrahydratet.
Berylliumhalogenidene fås vanligvis som lange polymerkjeder av litt langstrakte tetraederformer, f.eks. ..Cl2BeCl2BeCl2BeCl2BeCl2BeCl2BeCl2.. De krystalliserer hydratisert fra vannløsning, og hydratvannet er så sterkt bundet at det ikke kan drives av ved oppvarming, det spaltes like gjerne av hydrogenhalogenider.
Fluoridet, BeF2, dannes som en glassaktig hygroskopisk masse ved oppvarming av ammoniumtetrafluoroberyllat, (NH4)2BeF4. Det er oppbygd av de samme polymerkjedene som de andre halogenidene, men med mer uorden. De to krystallformene som er kjent ser ut til å ha en stor likhet med formene kvarts og kristobalitt av silisiumdioksyd. Fluoridet løses i vann, men reagerer med vannet til et molekylært dihydrat, BeF2(H2O)2. Det smelter ved 555 °C til en seig væske med lav elektrisk ledningsevne. Smelten kan gjøres mer lettflytende og elektrisk ledende ved tilsetning av litiumfluorid fordi det dannes tetrafluoroberyllationer.
Berylliumklorid, BeCl2, lages ved å føre karbontetraklorid over berylliumoksyd ved 800 °C. Det er et hvitt, krystallinsk stoff med smeltepunkt 405 °C som løser seg i vann med varmeutvikling. Fra saltsyreløsninger av berylliumoksyd kan man dampe inn et hydratsalt [Be(H2O)4]Cl2. Med ammoniakk som løsningsmiddel dannes et ammoniakatsalt, [Be(NH3)4]Cl2, som er et stabilt, krystallinsk stoff som tåler oppvarming, men hydrolyseres i vann. Vannfritt klorid og bromid kan også dannes ved å varme opp bestanddelene sammen i et rør. Kloridet er lettløselig i oksygenholdige organiske løsningsmidler som f.eks. etere.
I likhet med aluminiumhalogenidene kan berylliumhalogenidene opptre som lewissyrer og danne kompleksioner som tetrafluoroberyllat, BeF42-, og tetrakloroberyllat, BeCl42-. Tetrafluoroberyllater kan lages ved å løse berylliumoksyd eller -hydroksyd i konsentrerte løsninger eller smelter av sure fluorider som NH4HF2. I 1M vannløsninger av ammoniumfluoroberyllat er ca. 15-20 % av ionene BeF3-. Fluoroberyllater av alkalimetaller har ofte en struktur som påfallende likner silikatene av jordalkalimetallene. For eksempel har NaBeF3 samme krystallform som CaSiO3, og Na2BeF4 har fire krystallformer som nøye tilsvarer de fire krystallformene til Ca2SiO4. Fluoroberyllatene av toverdige ioner likner på sulfatene, f.eks. har PbSO4 og PbBeF4 samme krystallstruktur og liknende egenskaper. Kloroberyllater kan lages ved sammensmelting av berylliumklorid og alkaliklorider, men kloroberyllationer kan ikke eksistere i vannløsning.
Det er mulig å lage dimere fluoro- og kloroberyllater med klorider av alkalimetaller, thallium, ammonium og nitrogenoksyd, f.eks. NaBe2Cl5 og Tl2Be2Cl6. For klorodiberyllatene er ionet bygd opp som en del av den polymeriserte kjeden i det rene berylliumkloridet, mens fluorodiberyllatene er bygd opp som endeløse skikt med heksagonale ringer av BeF4-tetraedre som deler hjørner omtrent som skiktsilikatene.
Analyse:
Løs et mistenkt berylliumpreparat i salt- eller salpetersyre, tilsett kaliumfluorid og kaliumoksalat for å felle innskuddsmetaller, aluminium og andre jordalkalimetaller. Filtrer fra evt. bunnfall. Hvis det dannes bunnfall ved tilsetning av kaliumacetat er det sannsynligvis påvist beryllium.
Fremstilling:
Industrielt fremstilles beryllium ved å finknuse malmen, oppvarme den med konsentrert svovelsyre under trykk, berylliumhydroksyd felles med en natriumhydroksydløsning og overføres til klorid eller fluorid med tilsvarende syrer og halogenidet smeltes og elektrolyseres eller (vanligst) reduseres med magnesium ved så høy temperatur (2240 °C) at magnesiumfluoridet fordamper og kan luftes vekk. Elektrolyse av en smelte av beryllium- og natriumklorid er også en foretrukket metode. Natriumkloridet tilsettes på grunn av den dårlige elektriske ledningsevnen til det smeltede berylliumkloridet.
Demonstrasjonsforsøk:
Vis fram beryll, akvamarin og smaragd og gjerne så mange andre varianter av beryll det er mulig å få tak i. Fell berylliumhydroksyd fra en kloridløsning, filtrer fra og løs en del av hydroksydet i syre og en del i base. Sett opp en oppsats med en kolbe som er tilknyttet til et kjølerør med et rørsystem. Løs først litt dinitrogentetroksyd, N2O4, i etylacetat og rør inn litt berylliumklorid i løsningen. Filtrer fra krystallene som danner seg, putt dem i kolben og varm opp kolben til 50 °C med et termostatelement eller manuelt termometerkontrollert oppvarming med plate eller bunsenbrenner. Se at det unnviker nitrogenoksyder. Varm berylliumnitratet du får videre opp til 125 °C. Krystallene fordamper til berylliumoksynitrat, Be4O(NO3)6, som kondenserer seg i kjølerøret. Tegn strukturen til oksynitratet. Alle forsøk med beryllium MÅ foregå i avtrekk på grunn av giftigheten. Sørg spesielt for å ikke få noen damper eller støv av beryllium eller berylliumforbindelser ut i lufta.
Noen viktige forbindelser:
Berylliumoksyd. Hvite, heksagonale
krystaller med tetthet 3,01 g/cm3, sm.p. 2530± 30 °C, kok.p. ca 3900 °C. Løselig både i konsentrert svovelsyre og smeltet kaliumhydroksyd, men tungt løselig i vann, bare 0,000008 mol/l ved 20 °C. Oksydet er hardt, og beryllium kan ripe glass på grunn av det tynne oksydlaget som danner seg i luft. Har en krystallform som dannes over 800 °C og er spesielt syrefast, den løses bare av en varm blanding av konsentrert svovelsyre og ammoniumsulufat.Berylliumklorid. Fargeløse krystallnåler som flyter ut i fuktig luft. Tetthet 1,899
g/cm3. Sm.p. 405 °C. Kok.p. 520(488) °C. Løses meget lett i vann, hydrolyserer i varmt vann. Meget lett løselig i alkohol, eter og pyridin, tungt løselig i benzen, kloroform og karbondisulfid, uløselig i ammoniakk og aceton.Berylliumoksalattrihydrat. Rombiske krystaller. Avgir et molekyl vann ved 100 °C, resten ved 220 °C, dekomponerer ved 350 °C. I liter vann løser 2,530 mol ved 25 °C.
Kaliumtetrafluoroberyllat. Fargeløse rombiske krystaller, smelter hvis det oppvarmes til det blir rødglødende. Løses i vann, 0,12 mol/l ved 20 °C, 0,322 mol/l ved 100 °C.
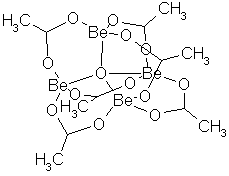
Berylliumoksyacetat, (CH3COO)6Be4O. Hvite, oktaedriske krystaller. Tetthet 1,36 g/cm3. Smeltepunkt 284 °C. Kokepunkt 331 °C. Løses ikke i vann. Løselig i kloroform, eddiksyre, tungt løselig i alkohol og eter. Løselig også i hydrokarboner og de fleste andre upolare løsningsmidler. Hydrolyseres av fortynnede syrer. Befinner seg i løsning som monomere molekyler og ioniseres ikke. Har vært brukt som et middel til å rense beryllium ved ekstraksjon med vann og et organisk løsningsmiddel. Liknende forbindelser dannes også med andre organiske syrer.
BIOLOGI
Beryllium og berylliumforbindelser er giftige, støv og damper fører til akutte og kroniske forstyrrer i organismen, særlig i lungene, huden og slimhinnene. Å smake på berylliumforbindelser for å sjekke om de er søte, slik de tidlige kjemikerne gjorde, er ikke særlig lurt. Giftvirkningen henger sannsynligvis sammen med evnen til å danne komplekser med f.eks. livsviktige metallkomplekserende proteiner som dermed blir funksjonsløse.
En spesiell helsefare i den tekniske industrien er inhalering av støv av berylliummetall og berylliumforbindelser, som gir lungeskader og en sykdomstilstand som kalles berylliose, og regnes for å være uhelbredelig. Lungekreft er også en risiko. Det anbefales at luft ikke skal inneholde mer enn 1 m g beryllium pr. kubikkmeter i gjennomsnitt for en 8-timers dag. Høyeste tillatte konsentrasjon er 5 m g/m3, og tiltaksgrensen er 0,5 m g/m3.
Det nasjonale laboratoriet i Los Alamos i USA har en hjemmeside hvor de presenterer en del forskning om berylliumrelaterte helsevirkninger og industrihygiene: http://lsdiv.lanl.gov/beryllium/
Det amerikanske energidepartementet presenterer programmet sitt for forebygging av berylliose her: http://tis.eh.doe.gov/be/ (men ikke ta den krystallstrukturfiguren for høytidelig, da...)
Bellonas berylliumside: http://www.bellona.no/imaker?sub=0&id=12796
Planter som vokser i berylliumrik jord inneholder beryllium, og det ser ut til at beryllium kan brukes i stedet for magnesium i et rimelig funksjonsdyktig klorofyll, men det har skadevirkninger for frøproduksjonen. Det er ikke kjent noen biologisk funksjon for de små mengdene beryllium som finnes i dyr, men mennesker får vanligvis i seg 0,01 mg beryllium pr. dag i kosten, og en person på 70 kg inneholder normalt 0,036 mg beryllium.
UTNYTTELSE
Det er elektrontettheten som bestemmer hvilken evne røntgenstråler har til å trenge gjennom et stoff. F.eks. trenger de vanskeligere gjennom knokler som inneholder mye kalsium enn gjennom hud og kjøtt, som inneholder mye karbon. Derfor brukes rent beryllium en del som "vindu" for strålene i røntgenapparater. Titt nærmere på røntgenapparatet neste gang du er hos tannlegen. De samme røntgenegenskapene er årsak til at ultratynn berylliumfolie brukes i såkalt røntgenlitografi til reproduksjon av mikrominiatyriserte integrerte kretser. Rent beryllium har også liten tilbøyelighet til å fange inn nøytroner og de lette berylliumkjernene bremser nøytroner effektivt ved støt. Derfor brukes det i atomreaktorer som moderator og som hylse for brenselselementene.
Beryllium har etterhvert fått et utstrakt bruk som konstruksjonsmateriale. Rent beryllium brukes i luftfarts- og romfartsteknikken og rakettvåpenteknikken. Romfergen har beryllium i vinduskarmene, bremseskivene og konstruksjonsbjelkene. Metallet brukes i gyroskoper, datamaskindeler, golfkøller, sportssykler og inertialnavigasjonsinstrumenter (INS) hvor letthet, stivhet og dimensjonsstabilitet er viktig. Små mengder beryllium (2-7 %) i kobber gir meget harde og faste legeringer, berylliumbronse. De er de sterkeste kobberlegeringene som finnes og de beste elektriske lederne av alle legeringer med høy styrke. De brukes i fjærer (f.eks. fjærer for motorstempler, ventilfjærer m.m.), elektriske kontakter, punktsveiseelektroder og gnistfritt verktøy til bruk i ildsfarlige omgivelser.
http://www.instrumentspecialties.com/ har en grundig innføring i design med berylliumbronse på hjemmesidene sine: http://www.instrumentspecialties.com/catalog/staticdata/designingwithberylliumcopper/dwbc_1.htm
Noen produsenter av berylliumprodukter:
http://www.plantfloor.com/ny/berylliummanufacturingcorp.htm
http://www.nsrw.com/material.htm
http://www.bermo.com/
http://www.hrollet.co.uk/
http://tedpella.com/grids_html/berylium.htm
http://www.ktekintl.com/
http://www.newmantools.com/ampco/
http://www.omegashielding.com/
http://www.goodfellow.com/
http://www.matthey.ch/
http://www.feuerherdt.de/
http://www.otra-salach.de/
Beryllium ble tidlig tatt i bruk som nøytronkilde. Slike lette kjerner som berylliumkjernene er utsatt for kjernereaksjoner når de bombarderes med ladde kjernepartikler selv om energien ikke er særlig høy, og når beryllium bombarderes med heliumkjerner dannes det karbonkjerner og nøytroner: 9Be + 4He = 12C + 1n. Det var denne reaksjonen som førte til oppdagelsen av nøytronet i 1932. Alfapartikler fra radium eller polonium er mer enn energirike nok til å oppnå denne reaksjonen, og blandinger av beryllium og et av disse stoffene har vært brukt som en transportabel nøytronkilde for nøytronaktiveringsanalyse og til å starte opp atomreaktorer. Atombomber er også vanligvis forsynt med en slik nøytronkilde for å sikre at de skal gå av.
Berylliumoksydet, BeO, brukes på grunn av det høye smeltepunktet i keramiske sammensetninger og i reaktorteknikken.
Noen større kommersiell berylliumproduksjon kom ikke i gang før i 1957, så bruk av beryllium i teknikken er et ganske moderne fenomen.
Hovedkilder:
Prof.dr.phil. Haakon Haraldsen (Asch.konv.leks.5.utg.b.2)
Per Kofstad, Uorganisk kjemi, Aschehoug, Oslo 1979.
Gunnar Hägg, Allmän och oorganisk kemi, Almqvist & Wiksell, Stockholm 1969.
F.Albert Cotton og Geoffrey Wilkinson, Advanced Inorganic Chemistry, Wiley 1988.
:-) LEF