| 1 | 18 | ||||||||||||||||
| H | 2 | 13 | 14 | 15 | 16 | 17 | He | ||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | Al | Si | P | S | Cl | Ar |
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Bh | Sg | Hs | Mt | ? | ? | ? | ? | ? | ? | ? | |||
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
As, atomnr. 33, molvekt 74,92159 g, elektronkonfigurasjon: (Ar)+4s2-3d10-4p3, sublimerer ved 613 °C, tetthet 2,03 g/cm3 (gult, ved 18 °C) og 5,73 g/cm3 (grått, ved 14 °C). Arsen hører til gruppe 15 i det periodiske systemet (også benevnt 5a eller V eller hovedgruppe 5 og kjent som 'pnikogenene'). Det har (1981) 25 kjente isotoper og isomerer, men den eneste stabile og den eneste som forekommer i naturen er 75. Av de omkringliggende radioaktive har hele seks stykker halveringstider på over ett døgn, med As 73 som den lengst levende på 80,3 dager. Arsen er derfor godt bevendt med muligheter for tracerstudier.
HISTORIE
Mein Name heisset Hütten-Rauch
Und bin ein gifftiger böser Schmauch.
Da aber Ich verlier den Gifft
Durch Kunst und rechte Handgriff.
So kan Ich Menschen und Vieh curiren
Auss böser Kranckheit offtmals führen.
Doch bereit mit recht
Und hab gut Acht
Dass du halst mit mir gute Wacht,
Sonst bin Ich Gifft und bleibe Gifft
Das manchems Hertz in Leib absticht.
Fra "Fr. Basilii Valentini chymische Schriften" ved Gottfried Liebezeit, Hamburg, 1694.
Marcus Vipsianus Agrippa hette en mann. Ved elven Rhenus sto han og så utover en svær dynge av falne germanere. Her skulle det anlegges en koloni, tenkte han. Og vips, så lå det en koloni der - og den ble hetende Colonia Agrippiniensis, senere Germanias største by og provinshovedstad. I byen satt en garver og gned et stykke skinn med et gult pulver. Det var for å fjerne hårene, slik han måtte før han kunne arbeide videre med det.
En mann hette Dominicus, var kannik i Osma, stiftet 1215 en munkeorden som ble av tidenes sultneste menneskeetere og i 1234, 13 år etter sin død ble han derfor hellig. Hans orden ble på folkemunne kjent som svartebrødrene (p.g.a. påkledningen) og "herrens hunder" (domini canes).
Albrecht hette en mann - det vil si, dette navnet kjentes han ikke ved. Du måtte kalle ham Albertus, ellers svarte han ikke. Ved Rhinens bredd satt han og foldet et gammelt skinn forsiktig ut med hendene. Allerede i 1223, 30 år gammel hadde han fulgt Dominicus' kall og gått ut i verden for å forsvare Det Ene Sanne. Men Albertus beskjeftiget seg ikke bare med å drepe kjettere. På hans tid flommet en masse ny viten inn i Europa gjennom manuskripter som kastillanere snappet ut av hendene på døende arabere i sør-Spania og gjennom det som korsridderne plyndret med seg fra Konstantinopel. Og det var denne strålende nye vitenskapens tidsalder Albertus hadde gjort til sitt livsverk. Gjennom sin lærergjerning ved dominikanerskolen i Köln kunne han samle og samordne alt som kunne skaffes av oldtidens store vismenn, samt av den nyere tids ikke fullt så ærverdige tenkere. Fordi han holdt på så mye med dette ble han litt mobbet av kollegene sine ved skolen. De kalte ham slike ting som "doctor universalis" og "Albertus Magnus," men han lot seg ikke merke med det.
Han ville ønsket at det han satt med foran seg nå var enda et uoppdaget manuskript av den strålende Aristoteles, allviteren, vitenskapenes far og den som gjennom sin logikk kunne bevise nesten alt mulig! Hans ambisjon var å gjennomføre dette systemets anvendelse på teologien, slik at Det Sanne kunne få enda solidere føtter å balansere på. Dette ventet han ikke å makte i sin livstid, men han satte stor lit til en av sine elever, den unge Thomas som hadde kommet fra Aquino i sør-Italia for å studere ved skolen.
Manuskriptet han nå holdt fullt utfoldet i hånden var dessverre bare en alminnelig apotekerforskrift, riktignok på gresk, men likevel. Albertus interesserte seg for alkymi. Mye av verkene han hadde samlet, både fra den arabiske og den gresk-romerske verden, handlet om å lage gull, og om biproduktene av denne aktiviteten. En dag satte han seg ned med et gult pulver som han hadde støtt fra et mineral de gamle kalte auripigmentum. Han blandet det med pulverisert såpe, varmet opp, og da han hadde studert resultatet, tilkalte han skriveren sin for å formidle opplevelsen. Og det er fra denne skriverens hånd vi har historiens første beretning om fremstilling av arsen.
Arsenmalmer og arsenforbindelser har vært kjent siden oldtiden, og trolig selve grunnstoffet også, selv om vi ikke har overleveringer om det. Grekerne og romerne grov ut auripigment og realgar med slavearbeidere, som måtte erstattes ofte p.g.a. giftigheten av substansene. Både som giftstoff og som medisin har arsenforbindelser urgamle tradisjoner, som verset over antyder. I oldtiden var både auripigment og realgar særlig viktige som fargestoffer. Auripigmentum er latin og betyr rett og slett gullfarge. Realgar gikk i romertiden og lenge etterpå under navnet sandaraca, etter gresk sandarake som betyr rødfarge. Realgar-navnet selv har arabisk opprinnelse. Auripigment ble forøvrig brukt som sminke og som hårfjerningsmiddel. Kineserne brukte arsenikk som insekt- og gnagergift og auripigment som kunstnerfarge og korreksjonsmiddel, fordi det hadde samme farge som rispapiret. De visste også hvordan man skulle teste på arsenikkforgiftning hos mennesker.
Alkymistene regnet bare med fire grunnstoffer, jord, vann, luft og ild. Også lenge etter alkymistenes tid ble gasser kalt luftarter og faste stoffer jordarter, senere bare oksyder. Arsen var en av jordartene. De grunnstoffene som var kjent fra oldtiden inntil Lavoisiers nye grunnstoffdefinisjon av 1789 var ikke etter tidens oppfatning vesensforskjellige fra stoffer som salt, pottaske, glass, kalk og sinober. Alle var sammensatt av de fire grunnelementene. Mange alkymister regnet arsen som et slags kvikksølv fordi det var flyktig, dannet amalgamliknende legeringer med metaller og fordi realgar påfallende likner sinober av utseende. Men alkymistiske skrifter fra 1600-tallet gir arsen et eget symbol, to ringer forbundet med en vannrett strek, og et symbolsk dyr, en slange.
Paracelsus beretter på 1500-tallet at man kunne få "metallisk arsenikk," hvitt som sølv, ved å opphete de gamles "arsenicum" (=auripigment) med eggeskall. I 1649 publiserte Johann Schröder to metoder for å fremstille arsen: ved å dekomponere auripigment med kalk og ved å redusere arsenikk med trekull. J.F. Henckel undersøkte i 1725 de metalliske egenskapene til arsen og viste hvordan det kunne fremstilles ved sublimering av kis. Men i 1733 klassifiserte Georg Brandt det som et halvmetall. Med det mente han noe som så ut som metall, men ikke var smibart. Lavoisier opptok det blant grunnstoffene i 1789.
Arsen og oksydet arsenikk har på mange språk, f.eks. svensk og engelsk, samme navn. Arsenikk stammer gjennom latin arsenicum fra gresk arsenikon, som grekerne brukte på auripigment. Da alkymistene begynte å oppdage at det grå stoffet de kunne fremstille fra auripigment og realgar var det samme, var de blitt kjent med greske skrifter, og brukte arsenikk som fellesbetegnelse for arsenforbindelser. Da de så senere klarte å fremstille oksydet, kalte de det hvit arsenikk, og siden de to andre forbindelsene allerede hadde egne navn ble betegnelsen bare hengende igjen ved det. Oksydet arsenikk kalles fremdeles ofte for hvit arsenikk i de språkene som ikke har eget navn på grunnstoffet.
Arsenikon hadde grekerne fra syrisk zarnig, mens syrerne hadde ordet fra persisk zaranya, som betyr gull. Zaranya kommer av zaray 'gul, gulaktig, gullfarge' fra oldiransk gheld og indoeuropeisk ghel- 'stråle, skinne, gul, gulgrønn.' Dette ordet har gjennom germansk og norrønt gitt opphav til norske ord som glimre, glimte, gløde, glo, glad, glede, glippe, glane og galle, gjennom oldsaksisk og middelnedertysk glatt, gli og glass gjennom old- og middelhøytysk glans og gjennom gresk kolerisk, melankoli og kolera. Indoeuropeisk gheluo 'gul, gulgrønn' stammer også fra ghel-, og ble gjennom germansk og norrønt til norsk gul mens det på gresk ble til chloros som betyr grønnliggul og opptrer i grunnstoffnavnet klor. I indoeuropeisk ble ghel- substantivert til gh(o)lo- 'det gule' og brukt i gh(o)lto-, betegnelsen på grunnstoffet gull, som gjennom germansk og norrønt har blitt vår egen. Det persiske ordet for gull, zaranya, som i senere persisk ble til zar, ble adjektivisert til zargun 'gullfarget.' Araberne lånte dette ordet som zarqún til å betegne mønje. Portugiserne lånte det fra dem igjen som zarcao og brukte det om zirkon, og ga dermed også grunnstoffet zirkonium sitt navn.
GEOLOGI
Arsen utgjør
0,0006 vekts-% av den øvre, faste jordskorpen og er nr. 42 på
denne statistikken, altså akkurat midt på av de 83 grunnstoffene
som har en selvstendig eksistens i vårt solsystem. Det ligger ufordelaktig
an i forhold til de "magiske" tallene 28 for protoner som det har for mange
av og 50 nøytroner, som det har for få av, og siden nuklider
med slike magiske tall har en fordel ved grunnstoffdanningsprosessene i
universet kommer det dårligere ut sammenliknet med slike relativt
nære naboer som kobber, sink, rubidium og yttrium.
Arsen forekommer vidt spredt og er (1976) en hovedkomponent av hele 265 mineraler, hvorav drøyt halvparten er arsenater. Nesten halvparten av disse arsenatmineralene er kjent fra og ofte unike for de mineralogisk berømte Långban-gruvene i midt-Sverige. Resten av arsenmineralene er arsenider eller for en stor del blandings-arsenid-sulfider, og en liten gruppe på 7, men deriblant noen av de viktigste er mineraler hvor arsen foreligger kationisk, mest som sulfid eller oksyd. Foruten hydrogen og oksygen er de grunnstoffene arsen oftest forekommer sammen med svovel med 77 mineraler, kobber med 54, jern 48, kalsium 44, bly 43, antimon 32, mangan 31, magnesium 26, nikkel 22, uran 19, sink 18, sølv 16, kobolt 14, palladium 13, aluminium 11 og natrium og thallium 10. Alkalimetallene er her sterkt underrepresentert, men det er fordi arsenatene deres er vannløselige.
Arseninnholdet i sjøvann er 3x10-7 til 2,4x10-6 %, og grunnstoffet er helt oppe på 22.-plass på den statistikken. Ellers merkes en påfallende affinitet til visse edle metaller samt til bly og thallium. Halvparten av alle thalliummineraler inneholder arsen. Långban-gruvene, som er en jern- og manganforekomst, er hovedansvarlig for overrepresentasjonen av mangan i statistikken. Alle de sterkt elektropositive metallene danner arsenater, mens de edlere og de mer elektronegative oftest danner arsenider. Alle thalliummineralene og halvparten av blymineralene er arsenider.
Arsen i magma krystalliserer oftest som arsenider og arsenosulfider eller som sulfider av arsen. Elementært arsen er heller ikke helt sjeldent. Arsenatmineralene er som regel sekundære produkter av oksydasjon i atmosfæren. Arsenets vidt spredte forekomst er årsak til at grunnstoffet ofte forurenser svovel eller metaller som er utvunnet av arsenholdig malm. Drikkevarer som har stått i krus laget av slike metaller har ført til forgiftningstilfeller. Ved røsting av kismalm og annen varmebearbeiding av malm og metaller som inneholder arsen fås flyktig arsenikk som et ofte uvelkomment biprodukt. Hütten-rauch i verset over henspiller på den giftige arsenikkrøyken i smeltehytter hvor arsenholdig jern behandles.
Arsenkis, mispickel eller arsenopyritt, FeAsS, er det viktigste arsenmineralet idag, et rombisk, sølv- eller tinnhvitt mineral med blekt gulaktig skjær, tungt, sprøtt og hardt, hardhet 5,5-6, tetthet omtrent 6 g/cm3. Ofte overtrukket av et glassaktig eller hårete hvitt forvitringslag av arsenblende eller arsenolitt som kjemisk er arsenikk. Inneholder gjerne en del kobolt og nikkel, ettersom det er isomorft og fullstendig blandbart med glaukodot, CoAsS, og med løllingitt, FeAs2, saffloritt, CoAs2, og rammelsbergitt, NiAs2, samt med markasitt, FeS2. Koboltholdig arsenkis har vært drevet på Skuterud i Modum. Er ofte assosiert med gull, bl.a. i Bindal i Nordland. Skellefteåfeltet i Sverige er den største forekomsten i verden og inneholder mye gull.
Andre viktige:
Koboltglans eller koboltarsenkis, CoAsS, et kubisk mineral med rødlig sølvhvit metallglans. En av de viktigste koboltmalmer og har vært drevet i Modum i Buskerud. (Blaafarveverket.)
Skutteruditt, CoAs2-3, blankt til svakt grått mineral som ble utvunnet ved Skuterud i Modum.
Løllingitt, FeAs2, et rombisk, hvitt til stålgrått mineral som finnes ved mange kisforekomster, bl.a. ved Sulitjelma, ofte i langstrakte krystaller.
Nikkelin, kobbernikkel eller rødnikkelkis, NiAs, metallglinsende lyst kobberrødt.
Proustitt eller lys rødgyldigerts, Ag3AsS3, et trigonalt, bløtt, rødlig mineral som bl.a. finnes ved Kongsberg.
Auripigment, As2S3, et vakkert gult mineral med perleglans. Opptrer sammen med sølv og blymineraler, ofte assosiert med realgar.
Realgar, As4S4, et vakkert, oransjerødt mineral med ravliknende glans.
Erytrin eller koboltblomst, Co3(AsO4)2.8H2O, er et vakkert rødfarget forvitringsmineral av koboltglans som er funnet i Buskerud ved Snarum-Modum, Kongsberg og Åserud ved Drammen.
Cerulein, Cu4Al14(AsO4)8(OH)2.23H2O, en turkisblå halvedelstein.
Lavendulan, NaCaCu5(AsO4)4Cl.5H2O, en rombisk krystalliserende, blågrønn halvedelstein.
Mimetitt, Pb(AsO)Cl, monoklint, psevdoheksagonalt, gult til brunt mineral i apatittgruppen.
Sverige er verdens største arsenprodusent. Ved opparbeiding av de gullholdige arsenkisforekomstene i Rönnskär ved Skellefteå fås årlig 20-40000 tonn arsenikk. Andre større produsenter er Mexico og USA, Egypt, Belgia og Tyskland.
KJEMI
Som fosfor har arsen
flere allomorfer. Den formen som er stabil ved romtemperatur er det grå
trigonale arsen, som danner stålgrå metallglinsende krystaller
og er en elektrisk halvleder med en resistivitet på 33,3 mikrohm
cm ved 20 °C. Den har en lagvis struktur av sikksakkbrettede sekskantenheter
hvor avstanden mellom atomene er 2.504 Å. Atomene i to lag som ligger
inntil hverandre befinner seg rett over hullene i sekskantene i det andre
laget. Korteste avstand mellom atomene i de to forskjellige lagene er 3,136
Å. Antimon og vismut danner liknende skiktstrukturer, og forskjellen
mellom de to nevnte avstandene er mindre for dem. Hvert arsenatom er bundet
til tre naboer innen skiktet og det skal derfor lite energi til å
danne As4-molekyler. Derfor har arsen ingen væskefase
ved normalt trykk.
Arsenkrystaller har den underlige egenskapen at de mellom 20 og 400 °C bare ekspanderer i en retning normalt på lagene ved oppvarming, mens de andre dimensjonene holder seg uforandret.
Arsendamp er gul og består under 800 °C av tetrahedriske As4-molekyler analogt med fosfor. Ved temperaturer rundt 1750 °C er de spaltet til diatomiske molekyler tilsvarende nitrogen.
Når arsendamper bråkjøles, fås gult arsen, som består av As4-molekyler og er en analog til det hvite fosforet. Det gule arsen er en isolator, det er reaktivt og lett oksyderbart, løser seg lett i karbondisulfid og i motsetning til det grå arsen er det i seg selv meget giftig. Utsettes det for lys og normale trykk- og temperaturbetingelser går det relativt raskt over til grått arsen.
Hvis arsendamp kondenseres ved 100-200 °C, dannes en amorf variant som kalles arsenglass eller også arsenspeil. Egentlig består det av en oppbrutt gråarsenstruktur. Det er lettere enn grått arsen, med tetthet 4,73 til 5,18 g/cm3. Det har en svart metallisk glans, men er en elektrisk isolator.
En tredje modifikasjon kan lages av arsendamp i kontakt med kvikksølv. Den er svart og har samme rombiske krystallstruktur som svart fosfor, som den er blandbar med i alle forhold.
Grått arsen er stabilt i luft ved romtemperatur og må oppvarmes til 180 °C for at det skal brenne. Det brenner med en blå flamme og en eiendommelig løklukt til seskvioksyd As2O3. Også med nesten alle andre grunnstoffer forbinder arsen seg lett ved oppvarming. Allerede Georg Brandt i 1733 merket seg hvor mange stoffer som løste arsen. Arsen er amfotert, og er istand til å danne forbindelser både med syrer og baser. Svake syrer løser riktignok ikke arsen, men med konsentrert svovelsyre dannes komplekse sulfater. Salpetersyre oksyderer arsen til oksyd. Bare oksoionene og visse komplekser er løselige i vann. De binære forbindelsene er enten uløselige eller reagerer med vannet.
Med alkalimetallene og jordalkalimetallene danner arsen ganske saltaktige arsenider med relativt høye smeltepunker og hvor arsen har oksydasjonstallet -3. De har et ikkemetallisk utseende, oksyderes lett og hydrolyserer i vann under dannelse av arsin. Men krystallgitteret har mer metallisk enn saltaktig karakter.
De sjeldne jordartsmetallenes arsenider er mindre saltaktige enn alkali- og jordalkalimetallenes, men mer saltaktige enn de til overgangsmetallene (de d-orbital-fyllende metallene). Disse har ofte (men ikke alltid) metallglans, er uløselige i vann og leder elektrisk strøm.
Arsenidene av grunnstoffene i hovedgruppe 3 (13- eller III-gruppen) har unike elektriske egenskaper. De er alle halvledere, med en elektronstruktur som likner mye på de klassiske halvledergrunnstoffene i gruppe IV, med et valensbånd som er fylt av de 8 valenselektronene til de to bestanddelene og et tomt ledningsbånd over, i forskjellig energimessig avstand fra valensbåndet, mindre for de tyngre arsenidene. Disse forbindelsene har god elektronbevegelighet og viser betydningsfulle fotoelektriske og elektroluminescente egenskaper.
Arsenidene av germanium, tinn og bly har legeringskarakter og likeså forbindelsene av arsen med antimon og vismut.
Analogt med fosfor eksisterer det både et seskvioksyd med molekylformel As4O6, og et "pentoksyd," As4O10, men det er det førstnevnte som er det stabileste, og som dannes når arsen brenner.
Sulfidene er As4S10, As4S6, As4S4 og As4S3. De er sterkt farget og så godt som uløselige i vann. Også et selenid, As4Se6 er kjent, med tilsvarende egenskaper.
Arsensyre, H3AsO4, kan fremstilles av arsen(III)oksyd og konsentrert salpetersyre. Dette er en svak syre med pKa 2,25, 6,77 og 11,60, påfallende likt fosforsyre. Den danner vannløselige salter med alkalimetallene og ammonium, alle andre salter er uløselige eller tungt løselige. Hvis bare et av hydrogenene erstattes av alkali kan metaarsenater med formel NaAsO3 eller tilsvarende fås ved oppvarming. Disse er polymerer med sykliske eller langkjedete sammensetninger av AsO4-tetraedre. En dimer, As2O74-, kalles pyroarsenat, men verken pyroarsensyre eller andre polymerer av arsensyre kan eksistere selvstendig. Arsenatmineraler inneholder ikke kjeder, ringer, skikt og nettverk av tetraedre slik som silikatene, men atskilte arsenatgrupper.
Arsen(III)oksydet er amfotert, og løses både i basisk og i surt medium, lettest i basisk. Med baser dannes arsenitter. I motsetning til fosforsyrlingen som har en udissosierbar P-H-binding, består arsensyrling av As(OH)3. Den er en meget svak syre, med pKa 9,23, en sterkere base, med pKb 3,96. I sur løsning dannes As(OH)2+-ioner, mens det i basiske dannes As(OH)4- . Arsensyrling eksisterer bare i løsning. Ved inndamping fås oksyd.
I sur løsning virker arsensyre ganske sterkt oksyderende, mens arsenittioner derimot er et godt reduksjonsmiddel i basisk løsning. Tiosyrer og -syrlinger hvor ett eller flere av oksygenatomene er byttet ut med svovel har god stabilitet og danner salter som med ammonium og alkalimetallene er vannløselige, ellers ikke. Utfelte arsensulfider går i løsning hvis det tilsettes ammonium- eller alkalisulfidløsninger.
Også trihalogenidene har en sterkt kovalent karakter, med lave smeltepunkter. Fluoridet og kloridet er flytende ved romtemperatur, og bromidet smelter i hånden. Alle unntatt jodidet dekomponerer i vann ved romtemperatur, fluoridet særlig livlig. Jodidet trenger litt oppvarming for å dekomponere. De er gode løsningsmidler og har interessante elektrolyttiske egenskaper. Arsen danner også et ustabilt dijodid, et gassformig pentafluorid og et fast pentajodid med smeltepunkt 76 °C. Trihalogenidene er relativt sure og har evnen til å danne tetrahalogenoarsenater som krystalliserer ionisk med mange kationer. Det eksisterer også et pentafluorid, som er en gass ved romtemperatur.
Som nitrogen og fosfor danner arsen et trihydrid, arsin, AsH3, en brennbar gass som dekomponerer nokså langsomt til sine bestanddeler i luft. Arsin har ikke slik basekarakter som ammoniakk. Et arsoniumbromid, AsH4Br, er registrert ved 82 K, men dekomponerer raskt ved høyere temperatur. Fenyl stabiliserer imidlertid arsonium, og tetrafenylarsoniumklorid og -bromid er stabile ved romtemperatur, kloridet til og med i vann. Analogt med aminene kan mange organiske arsiner dannes ved å substituere hydrogenet med organiske radikaler. De fleste slike forbindelser er ganske labile og lettantennelige. De er gode reduksjonsmidler, og reduserer bl.a. dobbeltbindinger av karbon, slik at arsiner med umettede radikaler ikke kan dannes. Arsen har også mange andre organiske forbindelser. Kakodyl, (CH3)2AsAs(CH3)2, ble oppdaget allerede 1760, og kakodylradikalet, (CH3)2As-, er kjent fra mange forbindelser.
Analyse:
Som kvalitativ bestemmelse av arsen er Marsh-prøven meget følsom - den har felt mange hovmestere i tidens løp. I et reagensrør med 1 ml av den mistenkt arsenholdige løsningen tilsettes 1 ml konsentrert saltsyre og litt granulert arsenfri sink. Blandingen varmes forsiktig opp til det utvikles hydrogen jevnt. En kork som det er stukket et tilspisset glassrør i settes i reagensrøret. I glassrøret skal det være stukket inn en bomullsdott. Når luften er drevet ut av røret antennes gassen som strømmer ut av spissen. En kald porselensskål holdes mot flammen og hvis det er arsen i prøven dannes svarte, metallglinsende flekker på porselenet. ("Arsenspeil.") Arsen reduseres til arsin av hydrogenet. As(OH)3 + 6H = AsH3 + 3H2O. Arsin brenner i luft, men inne i flammen er forbrenningen ikke fullstendig: 4AsH3 + 3O2 = As4 + 6H2O. Antimon danner også slikt "speil" men til forskjell fra arsenspeilet kan det ikke vaskes bort med natriumhypokloritt. Hvis prøven inneholder noen mengder arsen er det best å utføre forsøket i avtrekk, da arsin er en meget giftig gass.
Kvantitativt bestemmes
arsen best volumetrisk, d.v.s. ved titrering. En løsning som inneholder
en ukjent mengde arsen(III)oksyd tilsettes stivelse og titreres med en
jodløsning i alkohol med kjent konsentrasjon. Når den ukjente
løsningen får varig blåfarge avleses volumet. Reaksjon:
As2O3
+ 2I2 + 2H2O = As2O5 + 4H+
+ 4I-. Arsen som arsenid i mineraler overføres til arsen(III)oksyd
ved røsting. Oksydet er flyktig og fanges opp i kjølerør.
Alternativt kan arsen destilleres av som klorid under 108 °C mår
mineraler løses i saltsyre. Arseninnholdet bestemmes ved veiing
av kloridet. Eneste mulige forurensing er germanium(IV)klorid, men dette
er ikke løselig i konsentrert saltsyre.
Fremstilling:
Arsen kan enkelt fås
av arsenkis ved å varme opp uten lufttilgang til arsenet sublimerer.
Denne prosessen frigjør ganske mye av arsenet, men ikke alt, og
det frigjorte arsenet vil også være forurenset av noe oksyd
og sulfid. Dette kan renses godt nok til vanlige formål ved å
resublimere det fra trekull eller i en hydrogenatmosfære. Til elektronikkindustrien
fremstilles ultrarent arsen ved å sublimere fra smeltet bly (da sulfidet
blir igjen som blysulfid), ved å krystallisere fra smeltet arsen
ved 30 atmosfærers trykk eller ved å konvertere til arsin,
som så renses med alkali og tørkes, hvorpå gassen spaltes
ved 600 °C. Når man sublimerer arsen som kan være forurenset
med antimon er det viktig å ikke varme opp til særlig over
sublimasjonspunktet, da damptrykket til antimon stiger raskt når
man kommer over 800 grader.
Demonstrasjonsforsøk:
Marshprøven er en bra demonstrasjon i seg selv. En annen interessant demonstrasjon er å sublimere metallisk arsen og bråkjøle dampen i et rør som er kjølt ned til en ganske lav temperatur. Kan man få kjølt ned røret med flytende nitrogen er det det beste, men det kan også gå hvis man pakker rundt røret med is og kjøler det i en dypfryser før man starter eksperimentet. Å se et metalliknende stoff fortette seg til gule krystaller er rene magien. Og like magisk forvandler det seg tilbake igjen.
Noen viktige arsenforbindelser:
![]()
Arsen(III)oksyd, arsenikk,
rottekrutt, giftmel, arsenitt, arsenolitt, arsenblende - kjært barn
har mange navn. Fargeløse kubiske krystaller eller fibrøs
masse. Tetthet 3,865 g/cm3, sublimerer ved 193 °C. Løses
i vann, men ikke lett, 0,061 mol/l ved 2 °C, 0,579 mol/l ved 100. Løselig
også i alkohol, alkali og saltsyre. Ved oppvarming til 180 °C
i fuktig miljø dannes monoklint arsen(III)oksyd som i mineralogien
heter claudetitt og strukturmessig ikke består av separate As4O6-molekyler,
men er makromolekylært. Strukturen tilsvarer nøyaktig auripigment.
Det er tettere (4,15 g/cm3) enn arsenolitten, men like flyktig.
Dampen består av As4O6-molekyler under 800
°C. Over 1800 er de helt spaltet til As2O3. Ved
bråkjøling fås en amorf glassaktig variant med tetthet
3,738 g/cm3. Den blir etterhvert ugjennomsiktig p.g.a. krystallisering.
![]()
Arsen(III)sulfid. Naturlig
auripigment. Gule til røde monokline krystaller. 3,49 g/cm3.
Sm.p. 300 °C, kok.p. 723 °C. Nesten uløselig i vann (2x10-7
mol/l ved 18 °C). Løselig i alkohol, alkali og alkalikarbonater.
Løser seg i alkalisulfidløsninger under dannelse av tioarsenitter.
Hvis sulfidet dannes ved å boble hydrogensulfid gjennom en arsen(III)-holdig
løsning vil det lett dannes et kolloid som stabiliserer seg ved
adsorpsjon av negative ioner. Koagulering oppnås ved å tilsette
syre. Arsen(III)sulfid er en halvleder med gode muligheter til variasjoner
av støkiometrien slik at man lett kan lage n- og p-typer. Energigapet
er relativt stort. Ved bråkjøling av smelte fås glass
tilsvarende oksydets. Slikt glass er gjennomsiktig for infrarødt
lys over et stort bølgelengdeområde.
![]()
Arsin, en fargeløs
gass med en selsom løkliknende lukt, tetthet 2,695 g/l, sm.p. -116,9
°C og kok.p. -62,5 °C. Molekylet er polart, med en pyramidestruktur
lik ammoniakk, men dipolmomentet er mye lavere, 0,22 debye mot 1,47. Det
er også tungt løselig i vann, men løselig i kloroform
og benzen. Som fosfin er det meget giftig og brenner lett i luft. Ved romtemperatur
er arsin nokså stabilt, men dekomponeres raskt ved oppvarming. Det
er et godt reduksjonsmiddel og oksyderes lett av selv moderate oksydasjonsmidler.
![]()
Arsentriklorid, en fargeløs,
oljeaktig væske som ryker i luft. Tetthet 2,163 g/cm3,
sm.p. -16.2 °C, kok.p. 130.2 °C. Dekomponerer i vann. Løselig
i fosfortriklorid, alkohol og eter. Er selv et godt løsningsmiddel.
Rent arsentriklorid dissosieres svakt i ioner 2AsCl3 <> AsCl2+
+ AsCl4- og har en viss elektrisk ledningsevne som
øker drastisk når det tilføres substanser som kan avgi
halogenidioner (NaCl, (CH3)4NBr etc.) eller oppta
dem (SbF5, FeCl3 e.l.). De førstnevnte blir
en slags "syre" og de sistnevnte en slags "base" i dette systemet.
![]()
Galliumarsenid. Mørkegrå
kubiske krystaller. Tetthet ca. 6 g/cm3. Sm.p. 1238 °C.
Utvider seg når det fryser. En halvleder med energigap 1,39 eV. Elektronbevegeligheten
er høy, 0,85 kv.m/V/s og den dielektriske konstanten lav, 12,5,
så den er f.eks. germanium overlegen til bl.a. dioder med variabel
kapasitans. P.g.a. det større energigapet er evnen til å produsere
strøm ved fotoelektrisk effekt bedre enn for silisium hvis lyset
inneholder mye ultrafiolett stråling, som f.eks. i verdensrommet.
Viser elektroluminescens som når strømmen går over en
viss grense blir koherent, d.v.s. at den kan danne grunnlag for lasere.
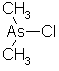
Kakodylklorid eller dimetylarsenmonoklorid.
Meget giftig og illeluktende væske. Tetthet 1,5046 g/cm3,
sm.p. <-45 °C, kok.p. 109 °C. Uløselig i vann og eter.
Løselig i alkohol.
BIOLOGI
Arsen spiller liten
rolle i det naturlige stoffskiftet hos dyr og planter. Derimot er arsenforbindelser
giftige for de aller fleste organismer. Arsenat i cellevæske og blod
konkurrerer med fosfatet under glykolysen og danner ustabile mellomstadier
som forhindrer produksjonen av energitransportørmolekylet ATP. Uten
ATP kan ikke cellene utføre arbeid.
Arsenikk interfererer også med enzymaktiviteten i stoffskiftet. Akutt arsenikkforgiftning ytrer seg omtrent som kolera eller en svær tarmkatarr, med hyppig, vanntynn avføring, sterke magesmerter, uttørking av kroppen, acidose, sirkulasjonssvikt og død innen få timer. Kronisk forgiftning gir en rekke symptomer som svakhetsfølelse, diaré eller forstoppelse, misfarging og avflassing av huden, lammelser, forvirring, degenerering av fettvevet, blodmangel og karakteristiske striper tvers over fingerneglene. Arsenikk er uten farge og smak og var en favoritt blant giftmordere til sikre tester ble utviklet for ca. 100 år siden. Dødelig dose for voksne mennesker regnes for å være 100-200 mg, men ved gradvis tilvenning kan man trene seg opp til å tåle doser opp til 500 mg uten å ta skade av det. Fjellførere i visse deler av Østerrike (Steiermark, Tirol) praktiserte dette for angivelig å få større utholdenhet og manndomskraft. Arsenikk brukes også i stor utstrekning av mennesker for å forgifte andre medskapninger. Både hvirveldyr, insekter, planter og mikroorganismer kan forgiftes med arsenikk. Standard motgift mot arsenikk er BAL ("British Anti-Lewisite"), også kalt dimerkaprol, 2,3-dimerkaptopropanol eller 1,2-ditioglycerol, CH2SHCHSHCH2OH, som feller arsenet som sulfid. Andre midler er kalkvann, Ca(OH)2 og epsomsalt, MgSO4.7H2O, som danner uløselige arsenat- eller arsenittsalter.
Arsinforgiftning resulterer først og fremst i ødeleggelse av røde blodlegemer, nyreskader og nervelidelser.
Flere arsenforbindelser brukes som medisiner, bl.a. arsenikk selv. For det meste er det giftvirkningen som ettertraktes. Arsenmidler brukes mot parasitter og mikrober og mot kreftsvulster. Arsenikk og arsenater har også blitt brukt mot hud- og blodsykdommer og som "styrkemedisin," men effekten er tvilsom, og bruk til mennesker er stort sett opphørt.
UTNYTTELSE
Arsen, slangestoffet,
er et grunnstoff som for det meste brukes til å drepe med. Giftvirkningen
av arsenikk danner grunnlag for det meste av det arsen som omsettes idag.
Og i tillegg har lenge et av de viktigste bruksområdene vært
som legeringsmetall i blyhagl for å gjøre dem rundere og hardere.
Heldigvis finnes det nå andre anvendelsesområder også.
Særlig har elektronikkindustrien fått et stort arsenbehov.
ikke bare går mye til produksjon av særlig gallium- men også
indium-, aluminium- og borarsenid, men arsen brukes også til å
"dope" germanium- og silisiumhalvledere for å lage n-type halvledere
med et overskudd av elektroner i krystallgitteret. Verdensproduksjonen
har lenge vært større enn forbruket, fordi så mange
malmer inneholder arsen, og dette har medført lagringsproblemer.
Men elektronikkindustrien er i ferd med å lindre denne plagen.
Foruten haglbly tilsettes arsen også i visse andre legeringer, bl.a. visse bronser for å bedre styrken ved høye temperaturer. Andre bruk av rent arsen er til bronsering og i fyrverkeri. Isotopene 72, 74 og 76 har vært brukt til tracerstudier, bl.a. i medisinsk diagnose.
Med arsenikk kan nesten hva som helst forgiftes. Rotter, mus, lus, fluer, mygg, ormer, parasitter, ugress, rike enker m.m. Men stoffet har også fredeligere bruk. Glassindustrien bruker det til avfargingsmiddel og for å hindre blæredannelse i glasset. Så har vi skinnindustrien, som bruker arsenikk også *etter* at dyret er drept, til pelsforbedrende middel og til konservering av huder, skinn og pelsverk. Arsenikk har også hatt medisinsk bruk, som nevnt over.
Arsensyre og arsenater er også giftige og brukes mot skadeinsekter i hage-, land- og skogbruk. De er mer vannløselige enn arsenikk, og vaskes lettere bort av regnet etter bruk. Foruten syren selv er blyarsenat, PbHAsO4 og kalsiumarsenat, Ca3(AsO4)2 mest brukt.
Arsenater brukes også til impregnering av treverk mot råte, sopp og skadedyr. Fowlers løsning er et remedium som inneholder kaliumarsenat, K3AsO4, og brukes ennå i dag som styrkemedisin til hest.
Scheeles grønt er et kobberarsenitt, CuHAsO3. Parisergrønt er kobberarsenitt-acetat. Disse vakre fargestoffene ble mye brukt tidligere, men visse mikrober er istand til å spalte arsin av dem, og det har forårsaket forgiftninger bl.a. ved bruk i tapeter. Førstnevnte stoff er forøvrig oppkalt etter Carl Wilhelm Scheele, en svensk kjemiker på 1700-tallet som døde i relativt ung alder, muligens av uforsiktig omgang med giftige kjemikalier.
Realgar brenner i blanding med salpeter og svovel med et blendende hvitt lys, såkalt bengalsk lys eller gresk hvitild. Dette var kjent allerede av de arabiske alkymistene og brukes fortsatt i fyrverkeriteknikken.
Arsin brukes som arsenkilde til halvledere som skal dopes. Den har også vært brukt som stridsgass.
Kakodylsyre, (CH3)2AsOOH, er et sterkt hygroskopisk stoff som brukes til tørkemiddel.
Arsenobenzen, C6H5As:AsC6H5, danner grunnlag for mange legemidler.
Salvarsan, arsphenaminum eller di-3-amino-4-hydroksyarsenobenzen-dihydroklorid-dihydrat, C6H3(OH)(NH2)As:AsC6H3(OH)(NH2).2HCl.2H2O, ble lansert i 1910 og var det første legemidlet som var effektivt mot syfilis. Andre varianter brukes bl.a. mot amøbedysenteri og andre parasittsykdommer.
Galliumarsenid er som nevnt mye brukt elektronisk, i elektriske lasere, solbatterier, måleinstrumenter, i dioder med variabel kapasitans, i mikrobølgelikerettere, diodebrytere og tunelldioder og mye mer.
Hovedkilder:
Prof.dr.phil. Haakon
Haraldsen (Asch.konv.leks.5.utg.b.1)
CRC Handbook of Chemistry
anf Physics, 57th ed. 1976-77.
Gunnar Hägg, Allmän
och Oorganisk Kemi, Almqvist & Wiksell, 1966.
Per Kofstad, Uorganisk
kjemi, Aschehoug, 1979.
J.D. Smith, The Chemistry
of Arsenic, Antimony and Bismuth, Pergamon Press, 1975.
Michael Fleischer, Glossary
of Mineral Species, US Geological Survey, 1975.
Mary Elvira Weeks, Discovery
of the Elements, Journal of Chemical Education, Easton, Pennsylvania, 1956.
:-) LEF